A Vertex, uma empresa de biotecnologia focada na criação de terapias médicas, e a CRISPR Therapeutics, uma empresa de propriedade de um dos descobridores da tecnologia de edição de genes CRISPR/Cas9, obtiveram a aprovação da FDA dos EUA para a primeira terapia CRISPR/Cas9 CASGEVY do mundo para tratar a doença falciforme.
A doença falciforme incapacita as pessoas afetadas devido à má formação da hemoglobina nas células sanguíneas, o que causa anemia, problemas de fluxo sanguíneo, danos ao baço e muito mais. As soluções atuais tratam principalmente dos sintomas de curto prazo, como a dor aguda(como esta na Amazon). A doença é causada por erros nos genes do DNA herdados dos pais, e muitos morrem antes dos 45 anos.
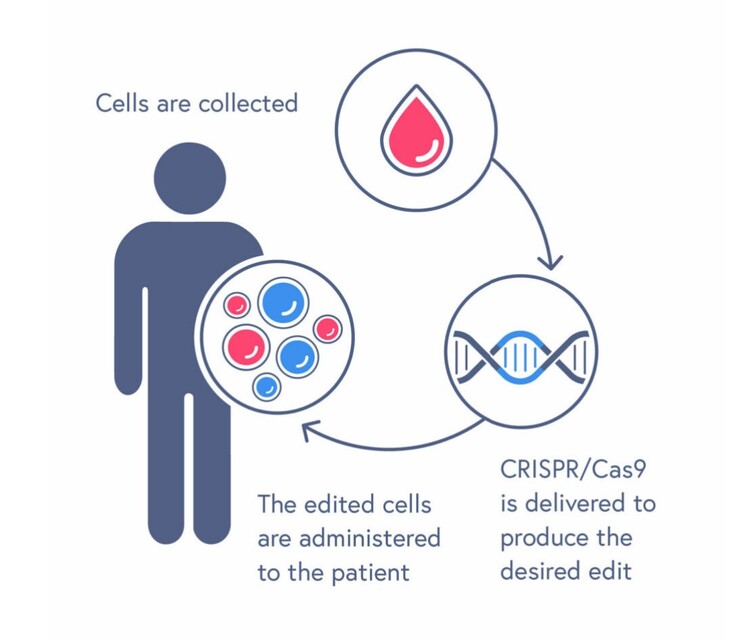
A CRISPR/Cas9 foi inventada em 2012 e é uma tecnologia de edição de genes premiada com o Nobel que permite localizar, cortar e editar facilmente regiões específicas dos genes. O CASGEVY utiliza essa tecnologia para eliminar erros nas células-tronco sanguíneas extraídas de um paciente e, em seguida, insere essas células de volta no corpo para curar a doença. Entretanto, o CASGEVY não está isento de riscos. Como a quimioterapia deve ser usada primeiro para eliminar todas as células sanguíneas ruins da medula óssea antes do transplante, mortes e complicações são comuns.
CASGEVY (exagamglogene autotemcel ou exa-cel) é um tratamento único para pessoas com mais de 12 anos de idade que pode reduzir bastante ou eliminar a doença falciforme. Esse tratamento foi aprovado para uso no Bahrein, Inglaterra, Escócia e País de Gales em novembro de 2023 e nos Estados Unidos em dezembro de 2023.
Os Top 10
» Os Top 10 Portáteis Multimídia
» Os Top 10 Portáteis de Jogos
» Os Top 10 Portáteis Leves para Jogos
» Os Top 10 Portáteis Acessíveis de Escritório/Empresariais
» Os Top 10 Portáteis Premium de Escritório/Empresariais
» Os Top 10 dos Portáteis Workstation
» Os Top 10 Subportáteis
» Os Top 10 Ultrabooks
» Os Top 10 Conversíveis
» Os Top 10 Tablets
» Os Top 10 Smartphones
» A melhores Telas de Portáteis Analisadas Pela Notebookcheck
» Top 10 dos portáteis abaixo dos 500 Euros da Notebookcheck
» Top 10 dos Portáteis abaixo dos 300 Euros
Fonte(s)
8 de dezembro de 2023
Vertex e CRISPR Therapeutics anunciam a aprovação do CASGEVY™ (exagamglogene autotemcel) pela FDA dos EUA para o tratamento da doença falciforme
- Primeira aprovação de uma terapia de edição de genes baseada em CRISPR nos EUA
- Aproximadamente 16.000 pacientes com 12 anos de idade ou mais com doença falciforme grave podem agora se qualificar para esse tratamento único
- Vários centros de tratamento autorizados foram ativados
BOSTON e ZUG, Suíça--(BUSINESS WIRE)--Dec. 8, 2023-- A Vertex Pharmaceuticals Incorporated (Nasdaq: VRTX) e a CRISPR Therapeutics (Nasdaq: CRSP) anunciaram hoje que a Administração de Alimentos e Medicamentos (FDA) dos EUA anunciou que o medicamento será administrado pela FDA. Food and Drug Administration (FDA) aprovou o CASGEVY™ (exagamglogene autotemcel [exa-cel]), uma terapia celular com edição de genoma CRISPR/Cas9, para o tratamento da doença falciforme (SCD) em pacientes com 12 anos ou mais com crises vaso-oclusivas recorrentes (VOCs). Essa aprovação significa que, pela primeira vez, aproximadamente 16.000 pacientes com SCD podem ter direito a uma terapia única e duradoura que oferece o potencial de uma cura funcional para sua doença, eliminando as COVs graves e as hospitalizações causadas por COVs graves.
"A aprovação do CASGEVY pela FDA é importante: é a primeira terapia de edição de genes baseada em CRISPR a ser aprovada nos EUA. Tão importante quanto isso, o CASGEVY é um tratamento de primeira classe que oferece o potencial de uma terapia única transformadora para pacientes elegíveis com doença falciforme", disse Reshma Kewalramani, M.D., CEO e Presidente da Vertex. "Quero transmitir minha mais profunda gratidão aos pacientes e pesquisadores cuja confiança nesse programa abriu caminho para essa aprovação histórica."
"Quando nossa empresa foi fundada, tínhamos a visão de traduzir a tecnologia CRISPR em múltiplas terapias inovadoras. Portanto, essa aprovação nos EUA do primeiro medicamento que usa a edição de genes CRISPR é de tirar o fôlego e um momento de verdadeira humildade para mim, pessoalmente, e para toda a organização", disse Samarth Kulkarni, Ph.D., presidente e CEO da CRISPR Therapeutics.
"Tem sido notável fazer parte desse programa inovador", disse Stephan Grupp, M.D., Ph.D., Chefe da Seção de Terapia Celular e Transplante e Diretor do Kelly Center for Cancer Immunotherapy no Children's Hospital of Philadelphia, e Presidente do Comitê Diretor do programa clínico CLIMB-121. "O CASGEVY tem o potencial de ser um tratamento transformador para os pacientes, e estou ansioso para continuar o trabalho para garantir que os pacientes elegíveis possam ter acesso a essa terapia em todo o país."
A administração de CASGEVY requer experiência especializada em transplante de células-tronco; portanto, a Vertex está se envolvendo com hospitais experientes para estabelecer uma rede de centros de tratamento autorizados (ATCs) operados de forma independente em todos os EUA para oferecer CASGEVY aos pacientes. Os seguintes ATCs já estão ativados:
Boston Medical Center, em Boston, Massachusetts.
Children's National Hospital, em Washington, D.C.
City of Hope Children's Cancer Center, em Los Angeles, Califórnia.
Medical City Children's Hospital, em Dallas, Texas
Methodist Children's Hospital em San Antonio, Texas
Nationwide Children's Hospital em Columbus, Ohio
The Children's Hospital at TriStar Centennial em Nashville, Tennessee.
The Ohio State University Comprehensive Cancer Center - James Cancer Hospital e Solove Research Institute em Columbus, Ohio
University of Chicago/Comer Children's Hospital em Chicago, Illinois.
Outros ATCs serão ativados nas próximas semanas e uma lista completa de ATCs, incluindo atualizações após a aprovação, pode ser acessada em CASGEVY.com.
Sobre o CASGEVY™ (exagamglogene autotemcel [exa-cel])
O CASGEVY é uma terapia celular com edição de genoma que consiste em células-tronco hematopoiéticas (HSCs) CD34+ autólogas editadas pela tecnologia CRISPR/Cas9 na região intensificadora específica para eritróides do gene BCL11A. O CASGEVY destina-se à administração única por meio de um procedimento de transplante de células-tronco hematopoiéticas em que as células CD34+ do próprio paciente são modificadas para reduzir a expressão de BCL11A nas células da linhagem eritroide, levando ao aumento da produção de hemoglobina fetal (HbF). A HbF é a forma de hemoglobina transportadora de oxigênio que está naturalmente presente durante o desenvolvimento fetal, que então muda para a forma adulta de hemoglobina após o nascimento. Foi demonstrado que o CASGEVY reduz ou elimina as crises vaso-oclusivas em pacientes com SCD.
O CASGEVY recebeu uma autorização condicional de comercialização na Grã-Bretanha pela Agência Reguladora de Medicamentos e Produtos de Saúde do Reino Unido e pela Autoridade Nacional Reguladora de Saúde do Bahrein para pacientes com 12 anos de idade ou mais com SCD caracterizada por crises vaso-oclusivas recorrentes ou talassemia beta dependente de transfusão (TDT), para os quais o transplante de células-tronco hematopoiéticas é apropriado e um doador de células-tronco hematopoiéticas relacionadas com antígeno leucocitário humano compatível não está disponível. O CASGEVY está atualmente sob análise da Agência Europeia de Medicamentos e da Agência Saudita de Alimentos e Medicamentos para SCD e TDT.
O uso de CASGEVY para o tratamento de TDT nos EUA permanece em fase de investigação. A Vertex submeteu um BLA ao FDA dos EUA para o uso potencial do CASGEVY em pacientes com 12 anos ou mais com TDT e foi atribuída uma data de ação alvo do Prescription Drug User Fee Act (PDUFA) de 30 de março de 2024.
Sobre os relatórios financeiros da Colaboração Vertex/CRISPR
A Vertex lidera o desenvolvimento global, a fabricação e a comercialização do CASGEVY com o apoio da CRISPR Therapeutics. Em conjunto com a aprovação do CASGEVY pela FDA, a Vertex fará um pagamento de marco de US$ 200 milhões à CRISPR, que será capitalizado e amortizado como custo de vendas. Além disso, a Vertex registrará 100% das receitas do CASGEVY; custos de vendas; e despesas de vendas, gerais e administrativas, e registrará a participação de 40% da CRISPR nos lucros ou perdas líquidas do CASGEVY em seu custo de vendas. Por fim, a Vertex registrará 60 por cento das despesas de pesquisa e desenvolvimento, líquidas da participação de 40 por cento da CRISPR.
Sobre a doença falciforme
A doença falciforme (SCD) é uma doença debilitante, progressiva e que encurta a vida. Os pacientes com anemia falciforme relatam índices de qualidade de vida relacionados à saúde bem abaixo da população em geral, e os custos de assistência médica ao longo da vida nos EUA para o tratamento da anemia falciforme em pacientes com VOCs recorrentes são estimados entre US$ 4 e US$ 6 milhões. A DF é um distúrbio sanguíneo hereditário que afeta os glóbulos vermelhos, que são essenciais para transportar oxigênio para todos os órgãos e tecidos do corpo. A DF causa dor intensa, danos aos órgãos e redução do tempo de vida devido à deformação ou "falcização" dos glóbulos vermelhos. A característica clínica da DF é a VOC, que é causada pelo bloqueio dos vasos sanguíneos pelos glóbulos vermelhos falciformes e resulta em dor intensa e debilitante que pode ocorrer em qualquer parte do corpo a qualquer momento. A DF requer tratamento por toda a vida e resulta em uma expectativa de vida reduzida. Nos EUA, a idade média de morte dos pacientes que vivem com a DF é de aproximadamente 45 anos. Atualmente, a cura para a DF é um transplante de células-tronco de um doador compatível, mas essa opção só está disponível para uma pequena fração dos pacientes que vivem com DF devido à falta de doadores disponíveis.
Ajudando os pacientes na jornada do CASGEVY
O Vertex Connects™ é um programa para pacientes elegíveis nos EUA aos quais foi prescrito o CASGEVY. Por meio do Vertex Connects, os gerentes de cuidados estão disponíveis para fornecer recursos educacionais, comunicações e suporte para navegar na jornada do tratamento, e assistência adicional está disponível para pacientes elegíveis.
Para obter mais informações sobre os ATCs, a jornada de tratamento do CASGEVY e o Vertex Connects, ligue para 1-833-VERTEX-5 (1-833-837-8395) - e saiba mais sobre nosso programa de apoio ao paciente em VertexConnects.com.
INDICAÇÕES E INFORMAÇÕES IMPORTANTES DE SEGURANÇA PARA CASGEVY (exagamglogene autotemcel) nos EUA
CASGEVY é uma terapia única usada para tratar pessoas com 12 anos de idade ou mais com doença falciforme (SCD) que têm crises vaso-oclusivas frequentes ou COVs.
O CASGEVY é feito especificamente para cada paciente, usando as células-tronco editadas do próprio paciente, e aumenta a produção de um tipo especial de hemoglobina chamado hemoglobina F (hemoglobina fetal ou HbF). Ter mais HbF aumenta os níveis gerais de hemoglobina e demonstrou melhorar a produção e a função das células vermelhas do sangue. Isso pode eliminar os COVs em pessoas com SCD.
INFORMAÇÕES IMPORTANTES SOBRE SEGURANÇA
Quais são as informações mais importantes que eu devo saber sobre o CASGEVY?
Após o tratamento com CASGEVY, o senhor terá menos células sanguíneas por algum tempo até que o CASGEVY se instale (se grave) em sua medula óssea. Isso inclui níveis baixos de plaquetas (células que normalmente ajudam o sangue a coagular) e glóbulos brancos (células que normalmente combatem infecções). O médico monitorará isso e administrará o tratamento conforme necessário. O médico dirá ao senhor quando os níveis de células sanguíneas retornarem aos níveis seguros.
Informe imediatamente ao seu médico se o senhor apresentar qualquer um dos seguintes sintomas, que podem ser sinais de níveis baixos de células plaquetárias:
dor de cabeça intensa
hematomas anormais
sangramento prolongado
sangramento sem ferimentos, como hemorragias nasais; sangramento nas gengivas; sangue na urina, nas fezes ou no vômito; ou tosse com sangue
Informe imediatamente ao seu médico se o senhor apresentar qualquer um dos seguintes sintomas, que podem ser sinais de níveis baixos de glóbulos brancos:
febre
calafrios
infecções
O senhor pode apresentar efeitos colaterais associados a outros medicamentos administrados como parte do regime de tratamento com CASGEVY. Converse com seu médico sobre esses possíveis efeitos colaterais. O seu médico pode lhe dar outros medicamentos para tratar os efeitos colaterais.
Como receberei CASGEVY?
O seu médico lhe dará outros medicamentos, incluindo um medicamento condicionante, como parte do seu tratamento com CASGEVY. É importante conversar com o seu médico sobre os riscos e benefícios de todos os medicamentos envolvidos no seu tratamento.
Depois de receber o medicamento condicionante, pode não ser possível para a senhora engravidar ou ter um filho. O senhor deve discutir as opções de preservação da fertilidade com seu médico antes do tratamento.
ETAPA 1: Antes do tratamento com CASGEVY, o médico administrará ao senhor um medicamento de mobilização. Esse medicamento move as células-tronco sanguíneas da medula óssea para a corrente sanguínea. As células-tronco do sangue são então coletadas em uma máquina que separa as diferentes células do sangue (isso é chamado de aférese). Todo esse processo pode ocorrer mais de uma vez. Cada vez, pode levar até uma semana.
Durante essa etapa, as células de resgate também são coletadas e armazenadas no hospital. Essas são as células-tronco existentes no seu sangue e são mantidas sem tratamento para o caso de haver algum problema no processo de tratamento. Se o CASGEVY não puder ser administrado após o medicamento de condicionamento, ou se as células-tronco sanguíneas modificadas não se fixarem (enxertarem) no corpo, essas células de resgate serão devolvidas ao senhor. Se o senhor receber células de resgate, não terá nenhum benefício do tratamento com CASGEVY.
ETAPA 2: Após serem coletadas, as células-tronco do seu sangue serão enviadas para o local de fabricação, onde serão usadas para produzir CASGEVY. Pode levar até 6 meses a partir do momento em que as células são coletadas para fabricar e testar o CASGEVY antes que ele seja enviado de volta ao seu médico.
ETAPA 3: Pouco antes do transplante de células-tronco, o seu médico lhe dará um medicamento condicionante por alguns dias no hospital. Isso o preparará para o tratamento, eliminando as células da medula óssea para que possam ser substituídas pelas células modificadas do CASGEVY. Depois que o senhor receber esse medicamento, seus níveis de células sanguíneas cairão para níveis muito baixos. O senhor ficará no hospital para essa etapa e permanecerá no hospital até depois da infusão com CASGEVY.
ETAPA 4: Um ou mais frascos de CASGEVY serão administrados em uma veia (infusão intravenosa) durante um curto período de tempo.
Após a infusão de CASGEVY, o senhor permanecerá no hospital para que o profissional de saúde possa monitorar de perto a sua recuperação. Isso pode levar de 4 a 6 semanas, mas os tempos podem variar. O profissional de saúde decidirá quando o senhor poderá ir para casa.
O que devo evitar depois de receber CASGEVY?
Não doe sangue, órgãos, tecidos ou células em nenhum momento no futuro
Quais são os efeitos colaterais possíveis ou razoavelmente prováveis do CASGEVY?
Os efeitos colaterais mais comuns do CASGEVY incluem:
Baixos níveis de plaquetas, o que pode reduzir a capacidade de coagulação do sangue e causar sangramento
Baixos níveis de glóbulos brancos, o que pode torná-lo mais suscetível a infecções
Seu médico examinará seu sangue para verificar se há níveis baixos de células sanguíneas (incluindo plaquetas e glóbulos brancos). Informe imediatamente ao seu médico se o senhor apresentar qualquer um dos seguintes sintomas:
febre
calafrios
infecções
dor de cabeça forte
hematomas anormais
sangramento prolongado
sangramento sem lesão, como hemorragias nasais; sangramento das gengivas; sangue na urina, nas fezes ou no vômito; ou tosse com sangue
Esses não são todos os possíveis efeitos colaterais do CASGEVY. O senhor pode relatar os efeitos colaterais à FDA. O senhor pode informar os efeitos colaterais à FDA pelo telefone 1-800-FDA-1088.
Informações gerais sobre o uso seguro e eficaz de CASGEVY
Converse com seu médico sobre qualquer problema de saúde.
Consulte as informações completas sobre a prescrição, incluindo informações ao paciente, do CASGEVY.
Sobre a Vertex
A Vertex é uma empresa global de biotecnologia que investe em inovação científica para criar medicamentos transformadores para pessoas com doenças graves. A empresa aprovou medicamentos que tratam as causas subjacentes de várias doenças genéticas crônicas que encurtam a vida - fibrose cística, doença falciforme e talassemia beta dependente de transfusão - e continua a avançar em programas clínicos e de pesquisa nessas doenças. A Vertex também tem um pipeline clínico robusto de terapias experimentais em uma variedade de modalidades em outras doenças graves, nas quais tem uma visão profunda da biologia humana causal, incluindo doença renal mediada por APOL1, dor aguda e neuropática, diabetes tipo 1 e deficiência de alfa-1 antitripsina.
A Vertex foi fundada em 1989 e tem sua sede global em Boston, com sede internacional em Londres. Além disso, a empresa tem unidades de pesquisa e desenvolvimento e escritórios comerciais na América do Norte, Europa, Austrália e América Latina. A Vertex é constantemente reconhecida como um dos melhores lugares do setor para se trabalhar, incluindo 14 anos consecutivos na lista dos Melhores Empregadores da revista Science e uma das 100 Melhores Empresas para se Trabalhar da Fortune. Para obter atualizações sobre a empresa e saber mais sobre a história de inovação da Vertex, visite www.vrtx.com ou siga-nos no LinkedIn, Facebook, Instagram, YouTube e Twitter/X.
Sobre a CRISPR Therapeutics
A CRISPR Therapeutics é uma empresa líder em edição de genes, focada no desenvolvimento de medicamentos transformadores baseados em genes para doenças graves usando sua plataforma proprietária CRISPR/Cas9. A CRISPR/Cas9 é uma tecnologia revolucionária de edição de genes que permite alterações precisas e direcionadas no DNA genômico. A CRISPR Therapeutics estabeleceu um portfólio de programas terapêuticos em uma ampla gama de áreas de doenças, incluindo hemoglobinopatias, oncologia, medicina regenerativa e doenças raras. Para acelerar e expandir seus esforços, a CRISPR Therapeutics estabeleceu colaborações estratégicas com empresas líderes, incluindo Bayer, Vertex Pharmaceuticals e ViaCyte, Inc. A CRISPR Therapeutics AG tem sede em Zug, Suíça, com sua subsidiária integral nos EUA, a CRISPR Therapeutics, Inc., e operações de P&D em Boston, Massachusetts e São Francisco, Califórnia, e escritórios comerciais em Londres, Reino Unido. Para obter mais informações, visite www.crisprtx.com.
A marca nominativa e o design CRISPR THERAPEUTICS® são marcas comerciais e marcas registradas da CRISPR Therapeutics AG. Todas as outras marcas comerciais e marcas registradas são de propriedade de seus respectivos donos.
Nota especial da Vertex sobre declarações prospectivas
Este comunicado à imprensa contém declarações prospectivas, conforme definido na Lei de Reforma de Litígio de Títulos Privados de 1995, conforme alterada, incluindo, sem limitação, as declarações de Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D. e Stephan Grupp, M.D., Ph.D., e declarações relativas à população de pacientes prevista e elegível para CASGEVY nos EUA, expectativas para os benefícios potenciais do CASGEVY, expectativas de que ATCs adicionais serão ativados nas próximas semanas, o plano da Vertex de fazer pagamentos de marcos para a CRISPR e o tratamento contábil antecipado da Vertex para pagamentos de marcos, receita antecipada, custo de vendas, despesas e lucros ou perdas líquidos relacionados ao CASGEVY. Embora a Vertex acredite que as declarações prospectivas contidas neste comunicado à imprensa sejam precisas, essas declarações prospectivas representam as crenças da empresa apenas na data deste comunicado à imprensa e há uma série de riscos e incertezas que podem fazer com que os eventos ou resultados reais difiram materialmente daqueles expressos ou implícitos por tais declarações prospectivas. Esses riscos e incertezas incluem, entre outras coisas, que os dados dos programas de desenvolvimento da empresa podem não apoiar o registro ou o desenvolvimento posterior de seus compostos devido a razões de segurança, eficácia ou outras, que a obtenção da aprovação e comercialização do CASGEVY na Europa e no Reino da Arábia Saudita pode não ocorrer no prazo previsto, ou ocorrer de todo, e outros riscos listados sob o título "Fatores de Risco" no relatório anual mais recente da Vertex e nos registros subsequentes arquivados na Comissão de Valores Mobiliários em www.sec.gov e disponíveis no site da empresa em www.vrtx.com. Os senhores não devem depositar confiança indevida nessas declarações ou nos dados científicos apresentados. A Vertex se isenta de qualquer obrigação de atualizar as informações contidas neste comunicado à imprensa à medida que novas informações se tornem disponíveis.
Declaração prospectiva da CRISPR Therapeutics
Este comunicado à imprensa pode conter uma série de "declarações prospectivas" dentro do significado do Private Securities Litigation Reform Act de 1995, conforme alterado, incluindo declarações feitas por Reshma Kewalramani, M.D., Samarth Kulkarni, Ph.D., e Stephan Grupp, M.D., Ph.D., neste comunicado à imprensa, bem como declarações relativas à CRISPR Therapeutics: (i) planos e expectativas para a comercialização de, e benefícios antecipados de, CASGEVY, incluindo a população prevista de pacientes elegíveis para CASGEVY nos Estados Unidos e o acesso dos pacientes ao CASGEVY; (ii) expectativas em relação aos ensaios clínicos exa-cel em andamento, incluindo implicações potenciais de dados clínicos para os pacientes; (iii) cronogramas e expectativas em relação a decisões adicionais de agências reguladoras; (iv) recebimento do pagamento de marco da Vertex; e (v) expectativas em relação ao valor terapêutico, desenvolvimento e potencial comercial das tecnologias e terapias de edição de genes CRISPR/Cas9. Sem limitar o que foi dito acima, as palavras "acredita", "antecipa", "planeja", "espera" e expressões semelhantes destinam-se a identificar declarações prospectivas. Os senhores são advertidos de que as declarações prospectivas são inerentemente incertas. Embora a CRISPR Therapeutics acredite que tais declarações se baseiem em suposições razoáveis dentro dos limites de seu conhecimento de seus negócios e operações, os investidores existentes e em potencial são advertidos de que as declarações prospectivas são inerentemente incertas, não são promessas nem garantias e não devem depositar confiança indevida em tais declarações, que se referem apenas à data em que foram feitas. O desempenho e os resultados reais podem diferir substancialmente daqueles projetados ou sugeridos nas declarações prospectivas devido a vários riscos e incertezas. Esses riscos e incertezas incluem, entre outros, que: os dados clínicos dos estudos clínicos em andamento do exa-cel não continuarão ou não se repetirão nos estudos clínicos em andamento ou planejados, ou podem não dar suporte à aprovação regulatória ou à renovação da autorização condicional; a aprovação regulatória em outras jurisdições pode não ocorrer nos prazos previstos ou não ocorrer de forma alguma; o preço ou o reembolso adequados podem não ser garantidos para dar suporte ao desenvolvimento contínuo ou à comercialização do exa-cel após a aprovação regulatória; a concorrência futura ou outros fatores de mercado podem afetar negativamente o potencial comercial do CASGEVY; A CRISPR Therapeutics pode não obter os benefícios potenciais de sua colaboração com a Vertex; há incertezas em relação à proteção da propriedade intelectual da tecnologia da CRISPR Therapeutics e da propriedade intelectual pertencente a terceiros; e os riscos e incertezas descritos sob o título "Fatores de Risco" no relatório anual mais recente da CRISPR Therapeutics no Formulário 10-K, no relatório trimestral no Formulário 10-Q e em quaisquer outros registros subsequentes feitos pela CRISPR Therapeutics junto à U. S. Securities and Exchange Commission.S. Securities and Exchange Commission, que estão disponíveis no site da SEC em www.sec.gov. A CRISPR Therapeutics se isenta de qualquer obrigação ou compromisso de atualizar ou revisar quaisquer declarações prospectivas contidas neste comunicado à imprensa, exceto na medida exigida por lei.
Veja a versão original em businesswire.com: www.businesswire.com/news/home/20231208951733/en/
Vertex Pharmaceuticals Incorporated
Investidores:
ou
Manisha Pai, +1 617-961-1899
Mídia:
ou
Internacional: +44 20 3204 5275
ou
EUA: 617-341-6992
ou
Heather Nichols: +1 617-839-3607
CRISPR Therapeutics
Investidores:
Susan Kim, +1 617-307-7503
Mídia:
Rachel Eides, +1-617-315-4493
Fonte: Vertex Pharmaceuticals Incorporated